บทคัดย่อ
งานวิจัยนี้ได้ศึกษาเทคนิคการถ่ายยีนเข้าสู่แคลลัสชนิด
embryogenic callus
ที่เจริญมาจากใบของกุหลาบ (Rosa hybrida)
พันธุ์ Carl Red โดย
ใช้เชื้อ Agrobacterium tumefaciens (A281/pBI121 )
เป็นพาหะ ซึ่งเชื้อ A281/pBI121 มี GUS gene
เป็น marker gene และมี kanamycin
เป็น antibiotic resistant gene (NPTII gene)
จากการทดลองพบว่าสามารถคัดเลือกแคลลัสที่ต้านทานต่อ
kanamycin ที่ระดับความเข้มข้น 100 มก/ล.
ได้ประมาณ 15 %
จากจำนวนแคลลัสทั้งหมด
เมื่อนำแคลลัสที่ต้านทานต่อ kanamycin
เหล่านี้มาทดสอบ GUS activity
พบจุดสีน้ำเงินบนก้อนแคลลัสและภาย
ในเซลล์ จากนั้นนำ transformed calli
เหล่านี้ไปตรวจสอบด้วยวิธี polymerase
chain reaction (PCR) เพื่อยืนยันในระดับ DNA
หลังจากตรวจสอบด้วย
gel electrophoresis แล้วพบ band ที่แสดง GUS gene
ที่ระดับ 1.2 kb และ band ที่แสดง NPT II gene
ที่ระดับ 0.7 kb ใน transgenic calli
ที่ตรวจสอบ
การทดลองนี้สามารถนำเทคนิคไปปรับใช้ในการสร้างระบบการถ่ายยีนอื่นๆที่มีความสำคัญทางเศรษฐกิจให้กับกุหลาบหรือไม้ดอกเศรษฐกิจชนิดอื่นเพื่อ
ใช้ในการปรับปรุงพันธุ์ต่อไป
Abstract
This research
studied on the techniques for gene transfer into embryogenic callus derived from leaves of
rose
(Rosa hybrida) cv Carl Red by using Agrobacterium tumefaciens
(A281/pBI121) as a vector. A281/pBI121 consists of
NPT II gene controling kanamycin resistant gene and GUS gene as a marker gene. The
experiment showed that
kanamycin - resistant calli in concentration 100 mg/l were selected from the total calli,
approximately 15 percent.
Kanamycin resistant calli were checked the GUS activity and showed strong GUS expression
(blue spot) on calli and
cells. Kanamycin - resistant calli obtained after treated with A281/pBI 121 were confirmed
by PCR analysis. The
predicted 1.2 kb band for GUS gene and 0.7 kb band for NPT II gene were detected in these
transgenic calli while these
bands were not detected in the untransformed control calli by using Agrobacteium
tumefaciens . These techniques
obtained will be utilized to transfer economical gene into rose or another economical cut
flowers for further plant
improvement.
คำนำ
กุหลาบเป็นไม้ดอกเศรษฐกิจที่มีความสำคัญมากชนิดหนึ่งในโลก
การปรับปรุงพันธุ์กุหลาบเพื่อให้มีคุณภาพดีนั้นสามารถทำได้โดยวิธีการคัดเลือก
และ
ผสมพันธุ์ ซึ่งต้องอาศัยเวลา
ความชำนาญและประสบการณ์
ในปัจจุบันนี้ได้มีการนำเทคโนโลยีชีวภาพมาใช้ในการสร้างพืชพันธุ์ใหม่ให้มีคุณสมบัติตามที่ต้องการ
ซึ่งเทคนิคนี้สามารถทำได้หลายวิธีเช่น
การใช้เชื้ออะโกรแบคทีเรีย
เป็นพาหะในการถ่ายยีน (Agrobacterium -
mediated gene transfer) การใช้เครื่อง
ยิงอนุภาค (Biolistic bombardment)
การรวมโปรโตพลาสต์ (protoplast fusion)
เป็นต้น
ซึ่งการเลือกใช้วิธีใดนั้นขึ้นอยู่กับชนิดและเนื้อเยื่อของพืช
ตลอดจนองค์ประกอบต่างๆ
ที่เป็นปัจจัยร่วม เช่น
ความยากง่ายในการแสดงออกของยีน
ความคงทนของยีนตลอดจนอุปกรณ์เครื่องมือและค่าใช้จ่ายสำหรับ
การทดลองในแต่ละครั้ง เป็นต้น
สำหรับวัตถุประสงค์ของงานวิจัยนี้คือศึกษาเทคนิคการถ่ายยีนในกุหลาบ
(Rosa hybrida) พันธุ์ Carl Red (รูปที่ 1) โดย
ใช้เชื้อ Agrobacterium tumefaciens เป็นพาหะ
อุปกรณ์และวิธีการ
1.
การเพาะเลี้ยงใบกุหลาบในสภาพปลอดเชื้อ
นำใบของกุหลาบที่ได้จากการเพาะเลี้ยงเนื้อเยื่อมาตัดออกเป็น
2 ชิ้นเท่ากัน
จากนั้นนำใบเหล่านั้นมาทดลองเลี้ยงในอาหารสูตร
MS ที่เติมสาร
ควบคุม การเจริญเติบโตในกลุ่ม auxin
คือ a naphthalene acetic acid (NAA) , 2,4 dichlorophenoxyacetic acetic
(2,4-D) acid
และ indolebutyric acid (IBA) ความเข้มข้นตั้งแต่
0.25 10 มก./ล. ตามวิธีของ Visessuwan et al 1997
จากนั้นนำมาเก็บไว้ในห้องควบคุม
อุณหภูมิและแสงเป็นเวลา 2 เดือน
เพื่อสังเกตการเกิดแคลลัส
2. การเลี้ยงเชื้อ
Agrobacterium tumefaciens (A281/pBI 121)
ร่วมกับแคลลัสชนิด embryogenic callus
นำแคลลัสที่มีสีเหลืองอมขาว
ผิวเรียบ ซึ่งเป็นแคลลัสชนิด
embryogenic callus มาแช่ในอาหาร เหลวสูตร LB
ที่เลี้ยงเชื้อ A281/pBI
แล้วทิ้งไว้ประมาณ 10 นาที
โดยวางบนเครื่องเขย่าความเร็วรอบประมาณ
100 rpm
เมื่อครบเวลานำแคลลัสมาวางบนกระดาษกรองที่นึ่งฆ่าเชื้อแล้วเพื่อซับเชื้อ
แบคทีเรียออกบางส่วน
จากนั้นย้ายมาเลี้ยงในอาหารสูตร
MS ที่เติม BA 2 มก./ล. เป็นเวลา 3 วัน
เมื่อครบเวลา
ย้ายมาเลี้ยงในอาหารสูตรเดิมที่เติม
claforan
500 มก./ล. เพื่อฆ่าเชื้อแบคทีเรีย
เปลี่ยนอาหารใหม่ทุก 2 สัปดาห์
โดยย้ายมาเลี้ยงในอาหารที่เติม
claforan ลดลงเหลือ 200 มก./ล. ร่วมกับ kanamycin
50 มก./ล. และค่อยๆ ลดความเข้มข้นของ
claforan ลงแต่เพิ่มความเข้มข้นของ
kanamycin เป็น 100 มก./ล.
เปลี่ยนอาหารประมาณ 3-4 ครั้ง
เพื่อคัดเลือก
แคลลัสที่ต้านทานต่อ kanamycin
3.
การตรวจสอบ transgenic callus
3.1
ตรวจสอบ transgenic callus โดยวิธี GUS assay
นำแคลลัสที่ต้านทานต่อยา
kanamycin มาแช่ในสารละลาย X - Gluc เป็นเวลา
4 ชั่วโมง อุณหภูมิประมาณ 37 ? C
ตามวิธีของ
Jefferson et al (1987) จากนั้นนำมาตรวจสอบ GUS
expression ซึ่งดูจากการเกิด blue spot
ภายใต้กล้องจุลทรรศน์
3.2
ตรวจสอบโดยใช้ poly merase chain reaction (PCR) analysis
นำแคลลัสที่ต้านทานต่อยา
kanamycin (transgenic callus) มาสกัด DNA ตามวิธีของ
Sambrook et al (1989) จากนั้นตรวจ
หายีน GUS และ NPT IIโดยวิธี PCR
ซึ่งวิเคราะห์ขนาดและชนิดของ DNA
ที่สกัดจาก transgenic callus ด้วย 0.8% agarose gel
electrophoresis ใช้ primer สำหรับตรวจสอบ GUS และ NPT
II gene ตามวิธีของ Hannill et al (1991) โดย band ของ GUS
gene และ
NPT II gene จะอยู่ที่ 1200 bp และ 700 bp ตามลำดับ

รูปที่ 1 กุหลาบ
(Rosa hybrida) Carl Red
ที่ใช้ในการทดลองการถ่ายยีน
|

รปที่ 2
การเพาะเลี้ยงใบกุหลาบพันธุ์
Cal Red เพื่อชักนำ
ให้เกิดแคลลัสในอาหาร Muras high and Skoog
ที่เติมสารควบคุมการเจริญเติบโต
NAA ความเข้มข้น
0.5 มก./ล. เป็นเวลา 2 เดือน
|
ผลการทดลอง
1.
การเพาะเลี้ยงใบของกุหลาบ
เมื่อนำต้นที่ได้จากการเพาะเลี้ยงเนื้อเยื่อของกุหลาบ
มาตัดใบออกเป็น 2
ส่วนเท่ากันและเลี้ยงในอาหารแข็งสูตร
MS
ที่เติมสารควบคุมการเจริญเติบโต
NAA, 2,4-D หรือ IBA ในความเข้มข้นตั้งแต่
0.25-10 มก./ล.
นั้นพบว่าแคลลัสสามารถเจริญที่บริเวณรอยตัดของใบและพบแคลลัสมีสีเหลืองอมขาวเกิดขึ้น
ในอาหารสูตร MS ที่เติม NAA 0.5 มก./ล.
(รูปที่ 2)
จึงคัดเลือกเฉพาะแคลลัสสีเหลือง
มาทดสอบโดยเลี้ยงในอาหารสูตร MS
ที่เติม BA 2 มก./ล. และ
แคลัลสเหล่านี้สามารถพัฒนาเกิดเป็นต้นอ่อนได้
จึงเรียกว่าเป็นแคลลัสชนิด embryognic
callus (รูปที่ 3)
ซึ่งจะนำมาใช้ในการทดลองที่ 2

รูปที่ 3
ลักษณะของ embryogenic callus ในระยะต่าง ๆ
เช่น globular stage, cotyledon stage
ที่พัฒนาขึ้นมาจากแคลลัสที่เจริญมาจากใบ
|
2.
การเลี้ยงเชื้อ Agrobacterium tumefaciens
(A281/pBI 121) ร่วมกับ embryogenic callus
หลังจากนำแคลลัสที่มีสีเหลืองอมขาว
ผิวเรียบ (embryogenic callus)
มาเลี้ยงร่วมกับแบคทีเรีย Agrobacterium
tumefaciens (A281/
pBI 121) เป็นเวลาประมาณ 3-4
เดือนเพื่อคัดเลือกแคลลัสที่ต้านทานต่อ
kanamycin ในอาหารสูตร MS ที่เติม BA และ claforan
200 มก./ล. ร่วมกับ
kanamycin 100 มก./ล. นั้น
พบว่าสามารถคัดเลือกแคลลัสที่ต้านทานต่อ
kanamycin ความเข้มข้น 100 มก/ล. ได้ประมาณ 15
% จากจำนวนแคลลัสทั้งหมด
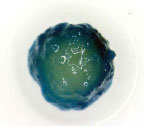 (ก) (ก)
|
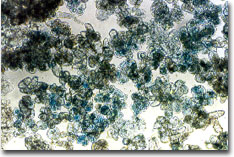 (ข) (ข)
|
รูปที่
4 การตรวจสอบ GUS gene expression (สังเกตจากจุดสีน้ำเงิน)
จากแคลลัส (ก) และภายในเซลล์
(ข) ที่ต้านทานต่อ kanamycin
ของกุหลาบพันธุ์ Carl Red หลังจาก transformed
กับเชื้อ Agrobacterium temefaciens (A281/pBI121) |
3. การตรวจสอบ
transgenic callusโดยวิธี GUS assay และ polymerase chain reaction (PCR)
analysis
หลังจากนำแคลลัสที่ต้านทานต่อ
kanamycin มาแช่ในสารละลาย X - Gluc เป็นเวลา
4 ชั่วโมง ที่อุณหภูมิ 37 ? C
พบว่าเกิดจุดสีน้ำเงินบนก้อน
แคลลัสและภายในเซลล์สังเกตภายใต้กล้องจุลทรรศน์(ดังแสดงในรูปที่
4 ก, ข)
จึงสันนิฐานว่าแคลลัสเหล่านี้ได้รับการถ่ายยีน
GUS และ NPT II แล้ว จึงนำ
transform ed calli
เหล่านี้ไปตรวจสอบด้วยวิธี PCR
เพื่อยืนยันในระดับ DNA
เมื่อตรวจสอบด้วย agarose gel electrophoresis
แล้วพบ band
ที่แสดง GUS gene ที่ระดับ 1.2 kb และ band
ที่แสดง NPT II gene ที่ระดับ 0.7 kb ใน transgenic calli
ที่ตรวจสอบ (รูปที่ 5)
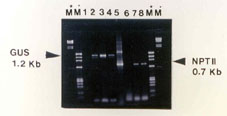
รูปที่ 5
การตรวจสอบ transgenic calli
ของกุหลาบพันธุ์ Carl Red ด้วยวิธี PCR
analysis
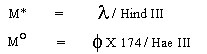
Amplication ของ Gus specific primer
อยู่ใน lane 1-4 และ NPT II-specific primer อยู่ใน lane 5-8
lane 1,6 = non-transformed control calli
lane 2,5 = DNA จาก plasmid pBI 121 สำหรับ Gus และ NPT II fragment
(positive
control)
lane 3,4 = แสดง GUS gene จาก DNA ของ transformed callilane 7,8 =
แสดง NPT II gene จาก DNA ของ transformed calli
|
วิจารณ์
งานวิจัยนี้สามารถถ่ายยีนเข้าสู่กุหลาบโดยใช้เชื้อ
Agrobacterium tumefaciens (A281/pBI)
ได้และมีประสิทธิภาพดีเนื่องจากเชื้อแบคทีเรียที่
ใช้จะเป็น strain
ที่รุนแรงจึงสามารถชักนำให้เกิด
transgenic callus ได้แต่เนื่องจากแบคทีเรีย
strain
นี้มีความสามารถในการสร้างแคลลัสสูง
(tumor
inducing)
จึงมีผลต่อการลดความสามารถในการชักนำให้เป็นต้นของแคลลัส
(embryogenic callus)
แต่อย่างไรก็ตามงานทดลองนี้ทำให้ทราบเทคนิค
พื้นฐานและขั้นตอนต่างๆ
ที่มีผลต่อการถ่ายยีนเข้าสู่กุหลาบสำหรับการทดลองต่อไปหากมีการใช้แบคทีเรีย
strain อื่นเช่น LBA4404 , EHA101 หรือตัวอื่นๆ
ที่ไม่มีผลต่อการชักนำให้เกิด tumor
อย่างรุนแรงจะมีโอกาสในการชักนำให้แคลลัสเกิดเป็นต้นได้มากขึ้น
สำหรับการศึกษานี้ใช้ embryogenic callus
เป็นตัว
รับยีนนั้นจะมีประสิทธิภาพดีและเหมาะสม
เพราะembryogenic callus
มีความสามารถชักนำให้เกิดเป็นต้นได้
หากมีการเปลี่ยนแปลงใช้แบคทีเรีย
strain อื่น
การเพาะเลี้ยงใบกุหลาบ
การใช้สารเร่งการเจริญเติบโต NAA
จะมีอิทธิพลสูงต่อการชักนำให้เกิด
embryogenic callus จากชิ้นส่วนของใบ และ
การใช้สารเร่งการเจริญในกลุ่มของ
cytokinin เช่น BA
แสดงบทบาทอย่างชัดเจนในการชักนำให้เกิด
adventitious shoots หรือเกิดเป็นต้นอ่อนจาก
embryogenic callus (Visessuwan. et al 1997)
สรุปผล
การทดลองนี้ประสบความสำเร็จในการถ่ายยีนสู่กุหลาบโดยใช้เชื้อ
Agrobacterium tumefaciens
เป็นพาหะซึ่งเทคนิคที่ศึกษาสามารถนำไป
ดัดแปลงและปรับใช้ในการถ่ายยีนอื่นๆ
ที่มีความสำคัญทางเศรษฐกิจ ( เช่น
ยีนที่สังเคราะห์เอมไซม์ในการสร้างสีในกลีบดอก,
ยีนชะลอการร่วงหรือยีนต้านทาน
ต่อโรคและแมลงเป็นต้น)
ให้กับไม้ดอกเศรษฐกิจชนิดต่างๆเพื่อการปรับปรุงพันธุ์ให้ดีขึ้นต่อไป
คำขอบคุณ
ผู้วิจัยใคร่ขอขอบคุณ
Prof. Dr. Masahiro Mii จาก Faculty of Horticulture, Chiba University
ประเทศญี่ปุ่นที่ได้ให้คำปรึกษาและ
แนะนำให้งานวิจัยนี้ประสบผลสำเร็จด้วยดี
เอกสารอ้างอิง
Hamill, J. D., S. Rounsley , A. Spencer G. Todd, and M. J. C. Rhodes (1991) The use of the
Polymerase chain reaction
in
plant transformation studies. Plant Cell Rep. 10: 221-224.
Jefferson, R. A., T. A. Kavanagh, M. V. Bevan (1987) GUS fusion: b - Glueuronidase as a
Sensitive and versatile
gene
fusion marker in higher plants. EMBO Journal 6: 3901- 3907.
Sambrook, J., E. F. Fritsch, and T. Maniatis (1989) Molecular Cloning, 2 nd
Edition, Cold Spring Harbour Laboratory
Press.
Visessuwan R., T. Kawai and M. Mii 1997 Plant regeneration systems from leaf segment
culture through embryogenic
callus
formation of Rosa hybrida and R. canina . Breeding Science 47 (3):217-222. |

